Hemoglobin là một loại protein phức hợp chứa sắt có trong hồng cầu của hầu hết các loài động vật có xương sống, đóng vai trò quan trọng trong việc vận chuyển oxy và carbon dioxide trong máu. Tham khảo bài viết NOVAGEN chia sẻ sau để tìm hiểu chi tiết hơn về loại protein này!
Nội dung:
1. Hemoglobin là gì? Chức năng của Hemoglobin
Hemoglobin (Hb hoặc Hgb) là một loại protein chứa sắt giúp vận chuyển oxy trong các tế bào hồng cầu. Hầu như tất cả các động vật có xương sống đều chứa hemoglobin, ngoại trừ họ cá Channichthyidae. Hemoglobin trong máu vận chuyển oxy từ các cơ quan hô hấp (phổi hoặc mang) đến các mô khác của cơ thể và giải phóng oxy tại đây để hô hấp hiếu khí cung cấp năng lượng cho quá trình trao đổi chất của động vật. Một người khỏe mạnh có 12 – 20g hemoglobin trong mỗi 100ml máu. Hemoglobin là một metaloprotein, một chromoprotein và cũng là một globulin.
Ở động vật có vú, hemoglobin chiếm khoảng 96% trọng lượng khô của tế bào hồng cầu (không bao gồm nước) và khoảng 35% tổng trọng lượng (bao gồm nước). Hemoglobin có khả năng liên kết oxy là 1,34ml O2 trên một gam, làm tăng tổng khả năng oxy của máu lên bảy mươi lần so với oxy hòa tan trong huyết tương máu đơn thuần. Phân tử hemoglobin ở động vật có vú có thể liên kết và vận chuyển tới bốn phân tử oxy.
Hemoglobin cũng vận chuyển các loại khí khác. Nó vận chuyển một số carbon dioxide hô hấp của cơ thể (khoảng 20–25% tổng số) dưới dạng carbaminohemoglobin, trong đó có CO2 liên kết với protein heme. Phân tử này cũng mang theo phân tử điều hòa quan trọng là oxit nitric liên kết với nhóm thiol trong protein globin, giải phóng nó cùng lúc với oxy.
Hemoglobin cũng được tìm thấy trong các tế bào khác, bao gồm cả trong các tế bào thần kinh dopaminergic A9 của chất đen, đại thực bào, tế bào phế nang, phổi, biểu mô sắc tố võng mạc, tế bào gan, tế bào trung mô của thận, tế bào nội mạc tử cung, tế bào cổ tử cung và tế bào biểu mô âm đạo. Trong các mô này, hemoglobin hấp thụ oxy không cần thiết như một chất chống oxy hóa và điều chỉnh quá trình chuyển hóa sắt. Lượng glucose dư thừa trong máu có thể gắn vào hemoglobin và làm tăng mức hemoglobin A1c.
Hemoglobin và các phân tử giống hemoglobin cũng được tìm thấy trong nhiều động vật không xương sống, nấm và thực vật. Trong các sinh vật này, hemoglobin có thể mang oxy hoặc chúng có thể vận chuyển và điều chỉnh các phân tử, ion nhỏ khác như carbon dioxide, nitric oxide, hydro sunfua, sulfide. Một biến thể gọi là leghemoglobin có tác dụng loại bỏ oxy khỏi các hệ thống kỵ khí như các nốt sần cố định nitơ của cây họ đậu, ngăn ngừa ngộ độc oxy.
2. Lịch sử nghiên cứu Hemoglobin
Năm 1825, Johann Friedrich Engelhart phát hiện ra rằng tỷ lệ sắt với protein là giống hệt nhau trong hemoglobin của một số loài. Từ khối lượng nguyên tử đã biết của sắt, ông đã tính toán khối lượng phân tử của hemoglobin thành n×16000 (n = số nguyên tử sắt trên một phân tử hemoglobin, hiện được biết là 4), lần đầu tiên xác định khối lượng phân tử của protein. “Kết luận vội vàng” này đã bị các đồng nghiệp chế giễu vì họ không tin rằng bất kỳ phân tử nào có thể lớn như vậy. Tuy nhiên, Gilbert Smithson Adair đã xác nhận kết quả của Engelhart vào năm 1925 bằng cách đo áp suất thẩm thấu của dung dịch hemoglobin.
Máu đã được biết đến là có khả năng vận chuyển oxy kể từ năm 1794, tính chất vận chuyển oxy của hemoglobin đã được Hünefeld mô tả vào năm 1840. Năm 1851, nhà sinh lý học người Đức Otto Funke đã xuất bản một loạt bài báo trong đó ông mô tả quá trình hình thành tinh thể hemoglobin bằng cách pha loãng liên tiếp các tế bào hồng cầu với dung môi như nước tinh khiết, rượu hoặc ete, sau đó làm bay hơi chậm dung môi khỏi dung dịch protein thu được. Quá trình oxy hóa thuận nghịch của hemoglobin đã được Felix Hoppe-Seyler mô tả vài năm sau đó.
Với sự phát triển của tinh thể học tia X, việc giải trình tự các cấu trúc protein đã trở nên khả thi hơn. Năm 1959, Max Perutz đã xác định được cấu trúc phân tử của hemoglobin. Công trình này đã giúp ông cùng John Kendrew – người đã giải trình tự protein hình cầu myoglobin giành được Giải Nobel Hóa học năm 1962.
Bên cạnh đó, vai trò của hbg trong máu cũng đã được nhà sinh lý học người Pháp Claude Bernard làm sáng tỏ.
Tên hemoglobin bắt nguồn từ các từ heme và globin, phản ánh thực tế rằng mỗi tiểu đơn vị của hemoglobin là một protein hình cầu có một nhóm heme nhúng. Mỗi nhóm heme chứa một nguyên tử sắt, có thể liên kết với một phân tử oxy thông qua lực lưỡng cực do ion gây ra. Loại hemoglobin phổ biến nhất ở động vật có vú chứa bốn tiểu đơn vị như vậy.
3. Cấu trúc của Hemoglobin
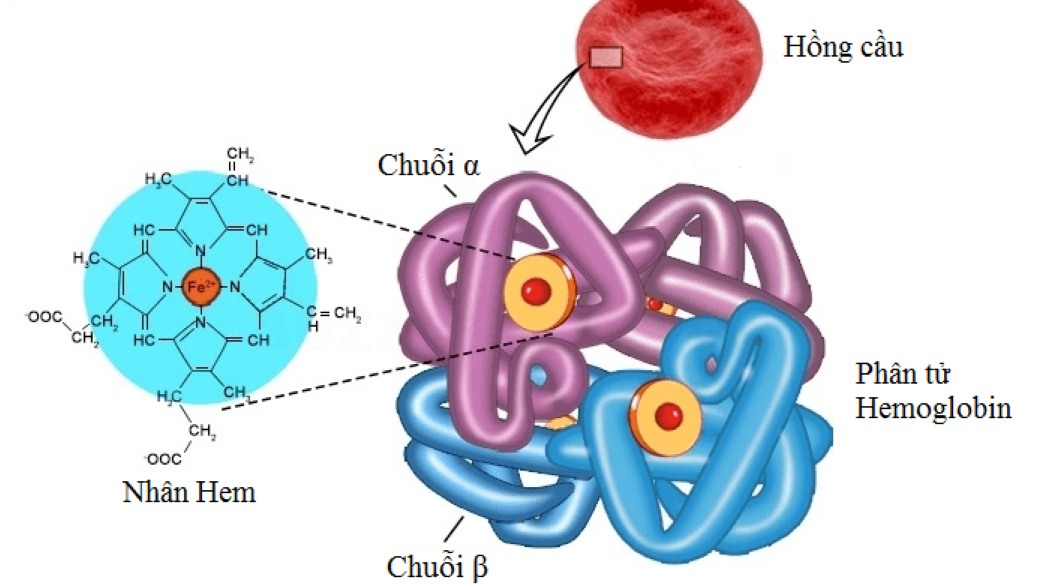
Hgb là một metalloprotein hình cầu có cấu trúc bậc bốn. Một phân tử hemoglobin bao gồm bốn tiểu đơn vị; mỗi tiểu đơn vị chứa một chuỗi polypeptide (chuỗi protein globin) gắn với một nhóm heme giả. Mỗi tiểu đơn vị nặng khoảng 16.000 Dalton, làm cho tổng trọng lượng phân tử của một phân tử Hgb là 64.000 Dalton.
Chuỗi polypeptide ở người lớn có hai loại, chuỗi alpha và chuỗi beta chứa lần lượt 141 và 146 axit amin. Hemoglobin ở người lớn có hai tiểu đơn vị alpha (α1 và α2) và hai tiểu đơn vị beta (β1 và β2) kết hợp thành hai dimer αβ được sắp xếp xung quanh trục đối xứng 2 lần. Mỗi tiểu đơn vị có một heme gắn vào protein globin. Trong Hbg của thai nhi, các tiểu đơn vị beta được thay thế bằng các tiểu đơn vị gamma (γ1 và γ2). Trong một lượng Hbg hiếm, các tiểu đơn vị beta được thay thế bằng các tiểu đơn vị delta (δ1 và δ2).
Nhóm heme chứa một sắt (ion sắt II, Fe2+) được giữ ở trung tâm của vòng porphyrin liên kết với các nguyên tử nitơ của vòng. Ion Fe2+ liên kết với túi của tiểu đơn vị globin bằng một gốc histidine. Mỗi ion Fe2+ có thể liên kết với một phân tử oxy (O2) hoặc một phân tử carbon dioxide (CO2).
4. Các loại Hbg ở người
Có một số loại hemoglobin khác nhau, trong đó ba loại phổ biến nhất là:
- Hemoglobin A: Đây là loại hbg chiếm khoảng 95 đến 98% tổng lượng hemoglobin ở người trưởng thành. Nó chứa hai tiểu đơn vị alpha và hai tiểu đơn vị beta.
- Hemoglobin A2: Hbg A2 chiếm khoảng 2 đến 3% tổng lượng hemoglobin ở người trưởng thành. Nó chứa hai tiểu đơn vị alpha và hai tiểu đơn vị gamma.
- Hemoglobin F: Đây là hbg của thai nhi và trẻ sơ sinh, có mặt với số lượng ít (dưới 1% ở người lớn). Nó chứa hai tiểu đơn vị alpha và hai tiểu đơn vị delta.
Bên cạnh các loại hbg chính này, còn có các dạng đột biến khác như hemoglobin E , hemoglobin S và hemoglobin C.
5. Các rối loạn, tình trạng bất thường liên quan đến Hbg
5.1. Các rối loạn máu liên quan tới giảm Hemoglobin
Hbg thấp được gọi là thiếu máu. Bất kỳ nguyên nhân nào cản trở số lượng, chức năng của huyết sắc tố hoặc hồng cầu đều có thể gây ra tình trạng thiếu máu.
Nguyên nhân gây thiếu máu bao gồm:
- Mất máu: Phẫu thuật, chảy máu đường tiêu hóa, kinh nguyệt ra nhiều.
- Giảm sản xuất hồng cầu: Tủy xương có thể không sản xuất đủ hồng dầu (thiếu máu không tái tạo; các tình trạng khác gây suy tủy; các bệnh ung thư như u lympho, bệnh bạch cầu, u di căn vào tủy xương,…).
- Tan máu: Đây là sự phân hủy hồng cầu, xảy ra với các tình trạng rối loạn như nhiễm trùng nghiêm trọng, tổn thương do độc tố, bệnh sốt rét.
- Thiếu hụt dinh dưỡng: Thiếu sắt, thiếu vitamin B12, thiếu folate có thể gây thiếu máu.
- Bệnh thận: Những người bị bệnh thận có thể không sản xuất đủ erythropoietin – một loại hormone thúc đẩy sản xuất tế bào hồng cầu.
5.2. Các rối loạn liên quan tới tăng Hemoglobin
Một số tình trạng có liên quan tới nồng độ Hbg cao bao gồm các bệnh về phổi (COPD, xơ phổi), bệnh tim bẩm sinh, bệnh tim xuất hiện khi mới sinh, bệnh tâm phế, suy tim phải. Với những trường hợp này thì cơ thể sẽ phản ứng với tình trạng thiếu oxy bằng cách tăng hemoglobin.
5.3. Các tình trạng bất thường về Hemoglobin
Các tình trạng huyết sắc tố có cấu trúc bất thường gồm có:
- Bệnh thiếu máu hồng cầu hình liềm: Đây là một tình trạng di truyền và ở những người mắc phải thì huyết sắc tố bất thường sẽ làm cho hồng cầu có hình liềm, có thể bị kẹt lại trong mạch máu gây ra đau đớn, xuất hiện các cục máu đông, tăng nguy cơ đột quỵ.
- Bệnh Thalassemia: Bệnh thalassemia là một loại bệnh di truyền khác. Có nhiều loại thalassemia khác nhau và các loại khác nhau lại được đặc trưng bởi các bất thường về hbg khác nhau với các triệu chứng khác nhau, từ không có đến nghiêm trọng. Trong đó, alpha thalassemia và beta thalassemia là hai loại chính.
Tham khảo: Wikipedia